Ensifentrine(恩塞芬汀)获FDA批准,20年来“first-in-class”疗法
Verona Pharma公司宣布,美国FDA批准其“first-in-class”磷酸二酯酶3/4(PDE3/4)抑制剂Ohtuvayre(ensifentrine)作为维持疗法治疗慢性阻塞性肺病(COPD)成人患者。新闻稿指出,这是具有支气管扩张和非类固醇抗炎作用的首个吸入式COPD疗法。此外,ensifentrine也是20多年来具有新作用机制、用于COPD维持治疗的首个吸入式疗法。该疗法也在今年初被行业媒体Evaluate列为2024有望获批的10款重磅疗法之一。
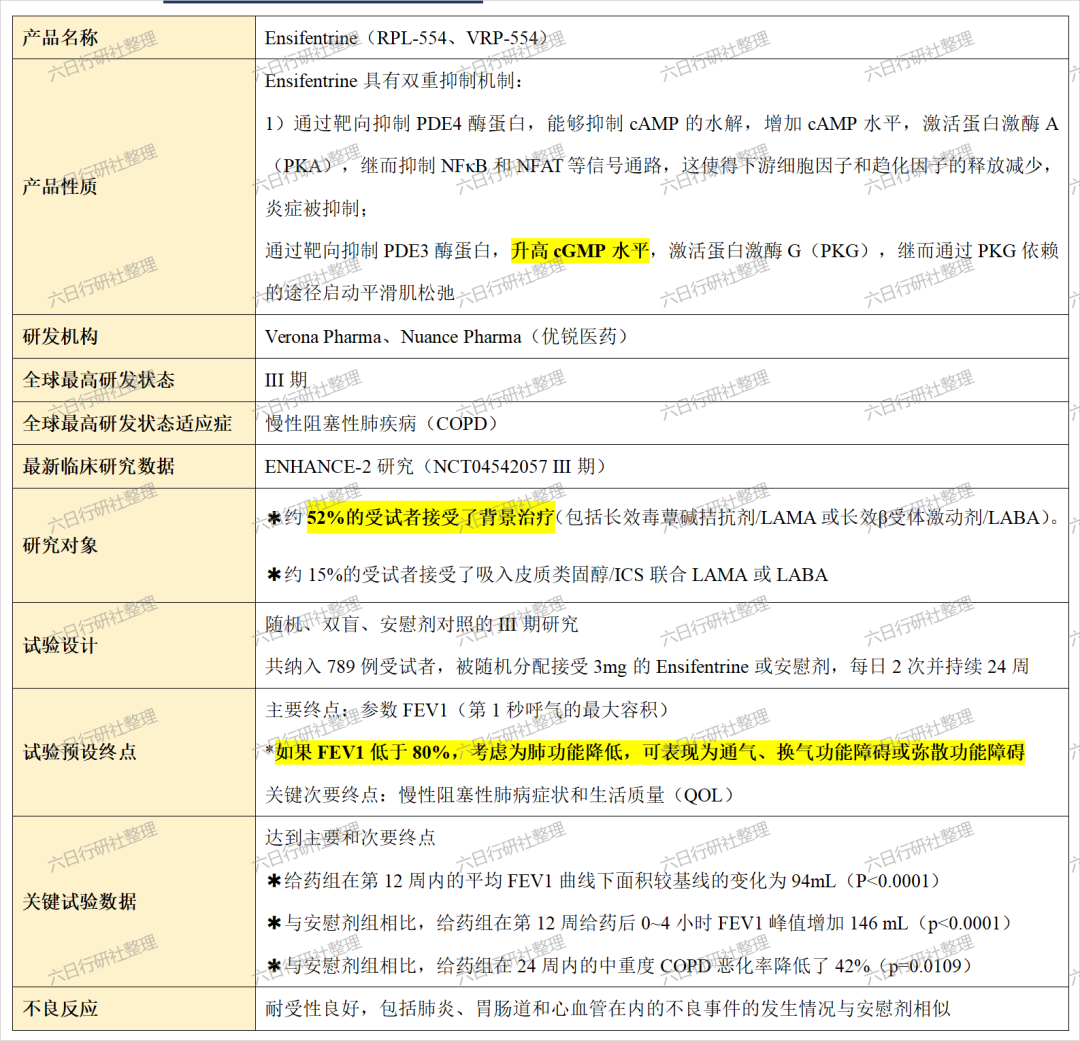
Verona在两项3期临床试验ENHANCE-1和ENHANCE-2中评估了雾化ensifentrine作为维持疗法,治疗COPD的效果。Ensifentrine在两项试验中均达到主要终点,患者肺功能获得统计显著和具有临床意义的改善。对ENHANCE-1和ENHANCE-2试验的合并数据分析显示,ensifentrine大幅度降低COPD恶化的风险。
ENHANCE-1试验共有763位COPD患者入组,试验主要终点为在使用药物后12周,在0-12小时内的平均1秒内用力呼气量曲线下面积(FEV1 AUC 0-12 hr)与基线相较的变化。此前公布的结果显示,在经过安慰剂组数值校正后,ensifentrine组数值为87毫升(p<0.0001)。这项在药物治疗组中具统计学与临床意义的改善可以在所有的病患亚群中观察到,无论患者的性别、年龄、吸烟状态、COPD严重程度、药物背景治疗、是否使用吸入皮质类固醇(ICS)等因素为何。此外,与安慰剂组相较,ensifentrine组患者在24周的试验当中,将COPD疾病恶化率降低36%(p=0.0505),并降低中重度恶化风险(通过对第一次恶化发生的时间来测量)达38%(p=0.0378)。
在48周的试验中,ensifentrine亦展现良好的耐受性,仅有少数患者出现不良反应。
Ensifentrine是一款“first-in-class”的PDE3/4抑制剂,双重抑制机理使其能够凭借单个化合物同时实现支气管扩张和抗炎效果。2021年6月,Verona公司授予优锐医药在大中华区临床开发和商业化ensifentrine的独家权利。
被严重低估的患者基数
在全球范围内,呼吸系统疾病位于前五大死亡原因之列,其中,哮喘及慢性阻塞性肺疾病(COPD)为主要发病类型。全球范围内,患有慢性呼吸系统疾病的人数保守估计已达到5.449亿,而其中COPD患者超过半数(约55%),每年有超过300万人因COPD及其并发症死亡。
在发达国家,慢阻肺已超越下呼吸道感染,位列死亡原因前三甲。根据2019年发表在柳叶刀(Lancet.)上的《中国慢性阻塞性肺疾病的患病率和危险因素(中国肺健康[CPH]研究)》研究成果,我国成人COPD患病总人数已经突破1亿人次,约占全球患者人数的四分之一。成人(≥20岁)慢阻肺患病率为8.6%,而在40岁以上人群中,已达到13.7%,60岁以上人群的患病率突破27%,男性的患病率明显高于女性(11.9% vs 5.4%)。
COPD已成为仅次于高血压和糖尿病的中国第三大常见慢性病和第四大经济负担疾病,并且随着生存环境的持续恶化和人类寿命的不断延长,患者人数会呈现持续增长趋势。
然而,受健康教育等因素的制约,我国的COPD知晓率不足10%,诊断率及控制率远低于欧美发达国家。
COPD和哮喘 傻傻分不清
慢性阻塞性肺疾病(COPD)与哮喘都存在气道炎症浸润,但其气道炎症特点存在明显差异。COPD患者气道炎症以中性粒细胞、CD8+ T淋巴细胞和巨噬细胞浸润为主;而哮喘主要以嗜酸性粒细胞、肥大细胞和 CD4+ T淋巴细胞浸润为主。
此外,IL-8是COPD形成中最为重要的炎症介质,而哮喘发病的关键炎症因子为IL-1β和IL-4。有趣的是,γ-干扰素在两种疾病中担任截然不同的角色,能够介导COPD的炎症反应,而对哮喘(过敏性)有治疗作用。
不同的气道炎症特征决定了两者的治疗原则差异明显。
吸入剂占据主导的百亿市场
慢性阻塞性肺疾病(COPD)主要累及的人体部位是支气管以及肺泡。相比于口服和注射剂等全身用药方案,经口吸入制剂(Orally inhaled drug products,OIDPs)更能巧妙地与呼吸系统的生理、组织学特征结合,因此成为国内外权威指南推荐的COPD防治的首选给药途径。
COPD市场需求十分庞大,2021年全球抗哮喘药物市场销售额突破200亿美元,预计2028年时,有望达到270亿美元。2021年,中国公立医疗机构终端OIDPs销售额突破215亿元(同比+23.8%)。
前瞻性评估
PDE 3/PDE 4抑制剂产品定位:联合用药。鉴于当前的治疗格局:长效β2受体激动剂(LAMA)已然成为慢性阻塞性肺疾病(COPD)的基础治疗。除去文中提及的积极III期数据,这款PDE 3/PDE 4抑制剂的一项2期试验(主要终点:FEV1)纳入噻托溴铵为背景治疗的COPD患者。遗憾的是,接受Ensifentrine治疗的患者,FEV1谷值较安慰剂组没有显著改善。推测可能是因为这款产品改善FEV1的疗效,无法持续12小时,而噻托溴铵对FEV1的改善是长效且强效的,并未给这款产品留下发挥空间。未来临床上,与Ensifentrine构效关系相似的品种大概率适合与长效抗胆碱能药物(LAMA)联用。
Ensifentrine产品生命周期长度:中等。
1)已有权威性研究证明,PDE 3对于PDE 4在COPD适应症的临床疗效方面,具有较为关键的作用:PDE 4仅部分抑制LPS刺激的人肺泡巨噬细胞(Alveolar macrophages)和树突细胞(Dendritic cells)的TNF-a释放;而同时针对PDE3B的PDE 3/PDE 4抑制剂,能够抑制约90%的LPS诱导的细胞因子分泌。
2)相比于2022版GOLD COPD(慢性阻塞性肺疾病全球倡议)中推荐的罗氟司特(适用于特定医疗场景,对于低、中度患者呼吸道症状改善不明显),这款不仅与其它药物联用能够起到1+1>2的效果,并且避免了口服产品带来的潜在中枢神经系统毒性毒性,很大程度缓解了失眠、头痛、体重下降或者抑郁倾向等不良反应。
3)作为吸入制剂,具备相关的技术壁垒:制剂工艺壁垒、装置壁垒、临床壁垒以及监管壁垒。
外部环境因素评估:良好。生物等效性试验(BE)相关政策现已逐渐明朗,相关产业发展将加速。吸入制剂属于“药械一体”,产品研发难度体现在CMC、临床、资金投入周期和审评等多个维度。相关BE标准和审评审批政策的正式文件正在逐步完善,会对于临床样本容量和临床试验操作给出更为明确的指导意见,生产设备昂贵等因素,为企业减少不必要的研究步骤和研发投入(昂贵的生产设备等)。
- 本类热文
- 安斯泰来的Fezolinetant(非唑啉坦)获批上市|1352阅读
- 扬子江药业垄断协议行为被罚7.64亿|1333阅读
- 工信部发布《化工园区认定条件和管理办法(试行)》|1327阅读
- Ensifentrine(恩塞芬汀)获FDA批准,20年来“first-in-class”疗法|772阅读
- FGFR抑制剂Futibatinib获FDA批准上市|742阅读
- 培西达替尼Pexidartinib|708阅读
- Trofinetide(曲非奈肽-DAYBUE)202303获FDA批准上市|683阅读

